J Hematol Oncol:研究发现CD32b是CLL患者CAR-T治疗的潜在靶点
慢性淋巴细胞白血病(CLL)是一种主要发生于老年人群的血液肿瘤,其中复发难治性(r/r)CLL患者预后差,治疗选择有限。以CD19为靶点的嵌合抗原受体(CAR-T)细胞在CLL中表现出活性,但仅能诱导约一半的患者完全缓解,临床亟需为CLL的辅助或联合CAR-T细胞治疗开发潜代靶点。
9月16日,J Hematol Oncol(影响因子17.388)发表了一篇题为“Homogeneously high expression of CD32b makes it a potential target for CAR-T therapy for chronic lymphocytic leukemia”(《CD32b的均匀高表达使其成为慢性淋巴细胞白血病 CAR-T 治疗的潜在靶点》)的研究。王国玲,孙晓蕾为第一作者。
该研究主要工作由中国医学科学院血液病医院实验血液学国家重点实验室冯晓明教授课题组完成,冯晓明教授、高博医学(血液病)北京研究中心北京博仁医院潘静主任、南开大学附属第一中心医院邓琦主任共同通讯作者。
该项研究发现,CD32b是CLL CAR-T治疗的一个潜在靶点,这为CLL患者的临床治疗带来新希望。

CD32b在CLL细胞上高密度均匀表达
肿瘤细胞上的靶抗原位点密度和表达百分比是CAR-T细胞治疗效果的关键决定因素。研究者在CLL患者的白血病细胞上检测B细胞相关抗原(CD19/CD20/CD22/CD32)和3个建议靶点(CD23/ROR1/FcμR)的表达水平。
结果发现,CD32b(FcγRIIb)在CLL患者的肿瘤细胞上以高密度均匀表达。与CD19相似,CD32(FCGR2)在所有患者的CD5+CD19+CLL细胞上100%表达,且其平均位点密度远高于CD19和其他抗原。
CD32有三种亚型:CD32a、CD32b、CD32c,其中CD32b与CD32c具有相同的胞外结构域。RNA测序结果显示,白血病细胞和Raji细胞表达丰富的CD32b和低水平的CD32c,但很少表达CD32a。
来自CD32b特异性抗体2B6的可溶性单链抗体证实,CD32b在CLL细胞上均匀高表达。CD32b在造血干/祖细胞和大多数成熟血细胞上没有显著表达,但在一小部分树突状细胞中表达。
体内外研究显示,CD32b CAR-T细胞具有CLL细胞毒性
随后,研究者开发了靶向CD32b的第二代CAR构建体,该构建体含有来自CD32b特异性抗体2B6和NOV2108的单链抗体。由于CLL细胞系MEC1仅部分表达CD32,故使用CD32b均匀表达的Raji细胞系来评估CD32b CAR-T细胞的活性。
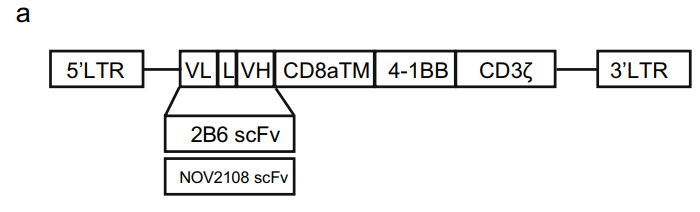
图 1 CD32b CAR序列结构图(来自克隆2B6或NOV2108的单链抗体)
研究发现,2B6bbz对Raji细胞的体外细胞毒性略高于2108bbz,且2B6bbz T细胞在Raji移植小鼠中增殖并显著降低肿瘤负荷和延长生存期。
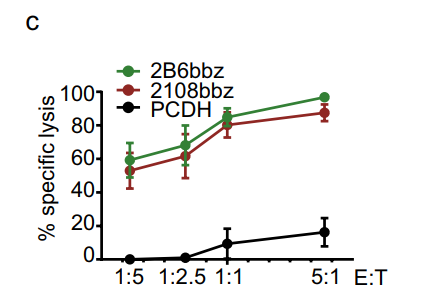
图2 在不同指定效应物与靶细胞(E:T)比率下孵育36小时后,
以CD32b CAR-T为靶细胞的Raji细胞的细胞毒性;对照T细胞作为阴性对照
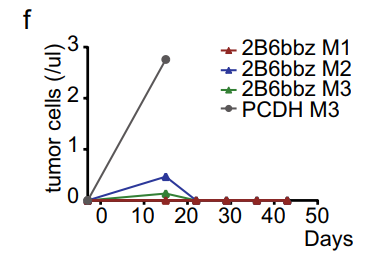
图3 流式细胞术分析Raji-NSG小鼠外周血中的Raji细胞
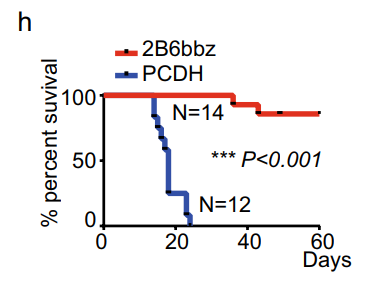
图4 2B6bbz或对照T细胞治疗的Raji异种移植小鼠的生存状况
2B6bbz对原代CLL细胞的体外毒性高于2108bbz。在白血病中,当CD19和CD32的表达相似时,2B6bbz T细胞显示出与CD19 CAR-T细胞相似的抗CLL细胞毒性;当CD32的表达高于CD19时,2B6bbz CAR-T细胞优于CD19 CAR-T细胞。此外,不同样本中2B6bbz T细胞的细胞毒性与CD32密度呈正相关。
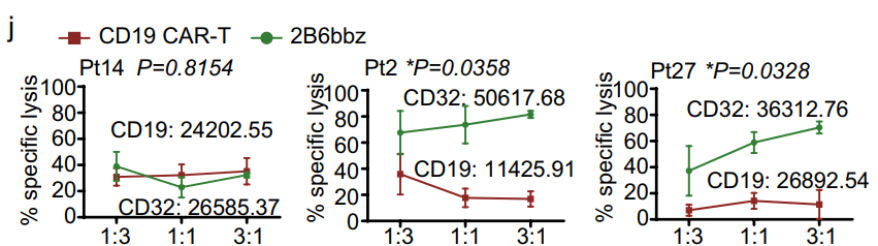
图5 在与原代CLL细胞以指定的E:T比率孵育36小时后,
2B6bbz和CD19 CAR-T细胞对CLL的特异性细胞毒性靶向性
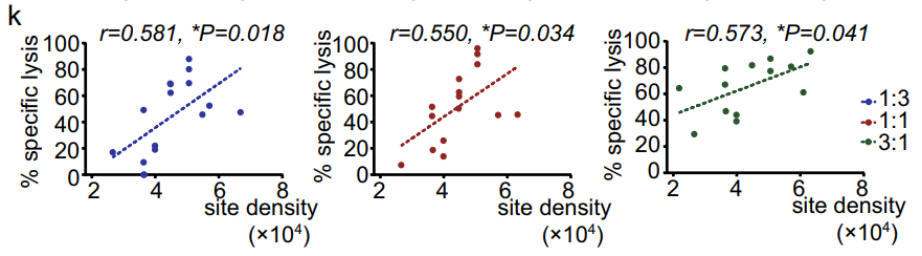
图6 不同CLL患者样本中2B6BZ T细胞毒性与CD32密度的相关性
此外,在移植患者样本的NSG小鼠中,2B6bbz T细胞与CD19 CAR-T细胞一样,具有抗CLL活性:它们在80%(8/10)的小鼠中完全清除CLL,并在大多数小鼠中显示出强劲的增殖能力。未观察到CD32b表达缺失。
由于CLL在小鼠体内的持久性有限,无法评估2B6bbz T细胞是否能提供长期治疗效果。由于该模型已被广泛用于评估新药在CLL中的体内疗效,故可以得知,CD32b CAR-T细胞在体内对CLL细胞具有强大的细胞毒性。
在不良反应方面,CD32b CAR-T细胞可能导致B细胞缺乏,这可通过输注免疫球蛋白进行治疗。
既往报道显示,CD32b表达于一些正常组织和细胞中,包括气道平滑肌细胞、肝窦内皮细胞、库普弗细胞和胎盘,可能导致CD32b CAR-T细胞治疗的潜在非靶向毒性。
然而CD32b仍然可能是一个适用的靶点,因为通过降低CAR对抗原的亲和力、采用安全控制开关,可以减轻潜在的脱靶毒性,这已在多种CAR-T细胞研究中得到验证。因此,基于这些修饰提高CD32b CAR-T细胞的安全性是可行的。
结 论
总之,此项研究确定了CD32b是一种在CLL细胞上高水平均匀表达的抗原,且CD32b CAR-T细胞在体外和体内对原代CLL细胞均有杀伤作用。CD32b是CLL CAR治疗的一个潜在靶点,不过在临床试验前可能需要对CAR结构进行进一步修改,优化其安全性,以尽量减少脱靶毒性。
专家述评:潘静主任
CAR-T细胞治疗的效果一定程度决定于肿瘤细胞表面的抗原密度,在此研究中,我们发现CD19虽然也是在CLL肿瘤细胞表面表达,但是密度并没有CD32b抗原密度表达高,相似的现象也见于CD22 CAR-T的治疗,所以为临床检测提出新的需求,如何定量测定抗原密度是否能更精确预测CAR-T治疗疗效提出待解决的问题。
另外,我们对其他肿瘤也做了相关的检测,比如和高博诊断中心高子芬教授团队的合作研究,有望发现在部分B系淋巴瘤患者中,该新靶点可能有应用价值。
我们也期待进一步的合作研究完成后的结果。
