高博医疗集团潘静主任2021年ASCO大会口头报告:供体来源CD7 CAR-T为难治复发T急淋患者带来治疗新选择

一年一度全球肿瘤学领域的第一大盛会——美国临床肿瘤学会(ASCO)年会将于2021年6月4日-8日以线上形式举办。ASCO年会是世界上规模最大、学术水平最高、最具权威的临床肿瘤学会议之一。肿瘤的诊断、治疗常以ASCO发布的研究为风向标,也正因此,ASCO年会上发布的研究通常都具有非凡的临床指导价值。
日前,2021 ASCO年会日程公布,中国学者共有17项研究获得口头报告发言(Plenary Session 1项;Oral Abstract Session 16项;Clinical Science Symposium 3项)。其中,高博医学(血液病)北京研究中心北京博仁医院潘静主任 的“Donor-derived CD7 CAR T cells for T-cell acute lymphoblastic leukemia”(供者来源CD7 CAR-T治疗急性T淋巴细胞白血病)获选大会口头报告,同时该项报告获选本次ASCO的年度会议Highlight摘要。
逆风破局:供体来源CD 7 CAR-T使T急淋的CAR-T治疗成为可能
CAR-T细胞疗法经过20余年的发展,已逐渐由基础走向临床,在肿瘤的免疫治疗,尤其是在血液肿瘤治疗中大放异彩,显著提升了复发难治B淋巴细胞白血病患者的缓解率及生存时间,而CAR-T细胞疗法在T淋巴细胞白血病中的应用始终未能有效推进。
阻碍CAR-T细胞治疗急性T淋巴细胞白血病的根本原因,主要是T细胞的特殊靶点问题,T细胞是人体正常免疫功能细胞,没有与肿瘤细胞区分的靶点,且急性T淋巴细胞白血病本身就是T细胞的病变,一旦复发,进展迅速,高瘤负荷可抑制正常T细胞增殖,这些均导致无法采集到足够的健康的T细胞,很大程度上限制了CAR-T细胞疗法在T急淋中的开展,同时可能会发生治疗相关的免疫缺陷疾病。
从2016年开始就有T系CAR-T产品生产出来,但都在临床前期,并没有突破到临床的数据出来,原因就在于T系CAR-T在临床应用非常难。
如何突破瓶颈?如何使CD7 CAR-T细胞治疗真正“成药”?潘静主任团队进行了持续探索,团队彻底放弃采用患者T细胞制备CAR-T细胞,转用供体来源CD7 CAR-T细胞治疗T淋巴细胞白血病。这一研究的设计理念在于希望绝大多数T急淋患者能有正常的T细胞可用,突破受限于T急淋患者肿瘤负荷高无法采集到足够T细胞,因此患者的肿瘤负荷不再是治疗限制,并且供体来源的CD7 CAR-T细胞治疗有望覆盖大多数T系血液肿瘤患者。
在动物模型中证实了其高抗肿瘤活性之后,潘静主任团队开展了单中心、单队列的Ⅰ期临床研究。
曙光初现:客观缓解率高达95%!
本研究共纳入20名患者,中位年龄为11岁(range,2-43),既往至少接受过2线治疗,其中12名患者既往接受过造血干细胞移植治疗,60%(n=12)的患者经历过血液学复发,且伴有髓外肿瘤。16名患者接受了剂量为1×106/KG(±30%)的供体来源CAR-T细胞输注,4名患者接受了5×105/KG的低剂量供体来源CAR-T细胞输注。
所有入组患者疗效均可评估,研究结果显示:CAR-T细胞输注后的第30天,客观缓解率(ORR)为95%(n=19),达到完全缓解(CR)且微小残留病灶(MRD)阴性率为85%(n=17)。
在对19名产生临床缓解的患者进行中位6.3个月(range,4-9.2)的随访后,7名CR的患者接受了造血干细胞移植的桥接治疗,其中6名患者保持无疾病生存(DFS)状态;其余11名未接受桥接治疗的CR患者中有9名患者仍处于DFS状态。从扩增水平上来看,所有留在CAR-T细胞扩增水平监测中的5名患者在输注后的6个月时仍能检测到CAR-T细胞的存在;直至末次评估,所有CAR转基因均可通过PCR检测到。
令人惊喜的是,该研究发现CD7 CAR-T治疗对髓外肿瘤也有强大的清除效果:9号患者的右肾病灶、15号患者的两处视神经病变以及16号患者的纵膈病变,在CAR-T细胞输注后的30天内都得到了完全的控制和缓解(图1)。
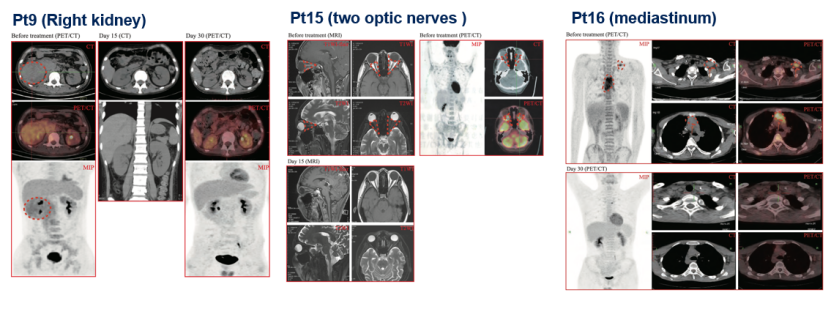
图1 CD7 CAR-T细胞治疗髓外肿瘤效果
道阻且长:临床问题仍需进一步探索
从疗效数据上可以看出几乎所有患者都对CD7 CAR-T细胞治疗产生了缓解,并且CAR-T细胞可以在患者体内产生长而持久的扩增,从而进一步增加长远缓解的益处和可能性。但潘静主任团队在研究进程中仍发现了一些临床问题需要进一步的讨论和探索。
从安全性数据上来看,未发生剂量限制性毒性(DLT)。所有患者均发生细胞因子风暴(CRS)和Ⅲ/Ⅳ级的血细胞减少症,15%的患者发生Ⅰ级神经毒性综合征(ICANS)。60%的患者发生移植物抗宿主病(GVHD),并且出现在CAR-T细胞输注后的早期。4名患者出现了CMV(巨细胞病毒)和EB病毒的再激活,1例患者于第5.5个月死于真菌性肺炎的肺出血(入组前有真菌感染史)。虽然所有入组患者均有不同程度的不良反应发生,但这些不良反应是可逆且可控的。
与治疗有关的免疫缺陷是另一个重要问题。潘静主任在研究中发现,CD7阳性的正常淋巴细胞(包括T细胞)在输注后15天内迅速耗尽,与此同时所有患者中CD7阴性的T细胞显著增加。因此,CD7阴性的T细胞可能具有缓解免疫缺陷的功能。团队已经展开了更多研究以检测CD7 阴性T细胞的相关功能和作用机制。
全新选择:难治复发T-ALL患者新希望
潘静主任团队的研究表明,供体来源的CD7 CAR-T细胞治疗是可行的,且R/R T-ALL患者可能能够从中获益。虽然不良事件发生程度可能较为严重,但是通过尽早发现,即时干预,是可管理的。
这种治疗方式或可以广泛应用于曾经接受过造血干细胞移植或符合移植标准并有可行供体来源的T-ALL患者。
潘静主任提到这一探索之所以取得如此好的疗效,在此要特别感谢患者及家属的信任,也感谢各团队的通力协作与支持,分别是高博医学(血液病)北京研究中心北京博仁医院、中国医学科学院血液病医院(中国医学科学院血液学研究所)、中国医学科学院北京协和医学院、上海雅科生物科技、中国药科大学、福建医科大学附属协和医院。
相关报道
血液前沿:【2021ASCO中国之声】潘静主任团队研究入选口头报告——供体来源CD7 CAR-T为R/R T-ALL患者带来治疗新选择
医学界:潘静教授:为R/R T-ALL治疗破局,供体来源CD7 CAR-T或可行!


