大咖观点丨郑勤龙主任:从免疫缺陷「看」HLH,分子检测打开新大门
噬血细胞性淋巴组织细胞增生症 (hemophagocytic lymphohistiocytosis, HLH) 是一种致命性的侵袭性免疫过度活化综合征。这种免疫调节异常主要由免疫系统的淋巴细胞、单核细胞和巨噬细胞等的异常激活、增殖,分泌大量炎性细胞因子而引起的一系列炎症反应。
临床以持续发热、肝脾肿大、全血细胞减少、高甘油三酯、低纤维蛋白原、高血清铁蛋白,以及骨髓、肝、脾、淋巴结组织发现噬血现象为主要特征。
如何对HLH进行准确诊断?二代测序 (next generation sequencing, NGS) 技术检测 HLH 相关基因地位及其意义如何?高博诊断中心分子诊断实验室郑勤龙主任带来了题为“免疫缺陷噬血基因NGS分子检测”的精彩报告,特此整理,以飨读者。
追本溯源,从免疫缺陷看HLH
郑勤龙主任首先介绍了人体免疫系统:由不同的免疫细胞和分子组成,以不同的方式在高度协调的反应中共同工作,以摆脱“入侵者”保护人体,分为先天免疫-首次应答者和适应性免疫-长期应答者。因此,免疫系统的失调或功能障碍的免疫缺陷会导致抵御感染的能力下降,更易发生癌症。
原发性免疫缺陷(PID)是由于遗传性或获得性基因缺陷导致的免疫缺陷,主要包括由体液免疫如B细胞或Th细胞缺陷引起的体液免疫缺陷,以及由细胞介导的固有免疫缺陷包括中性粒细胞或巨噬细胞补体。
主要的PID类型有以下九种:
联合免疫缺陷 (CID)
具有相关或综合征特征的 CID
抗体为主的缺陷
免疫失调性疾病
先天性吞噬细胞数量或功能缺陷
天然免疫缺陷
自身炎症性疾病
补体缺陷
IEI的拟表型
2020年JCO发表的1983年-2019年新报告的先天性免疫缺陷的基因数量统计显示:免疫缺陷相关的基因数量正在不断上升,目前已经达到400余个。
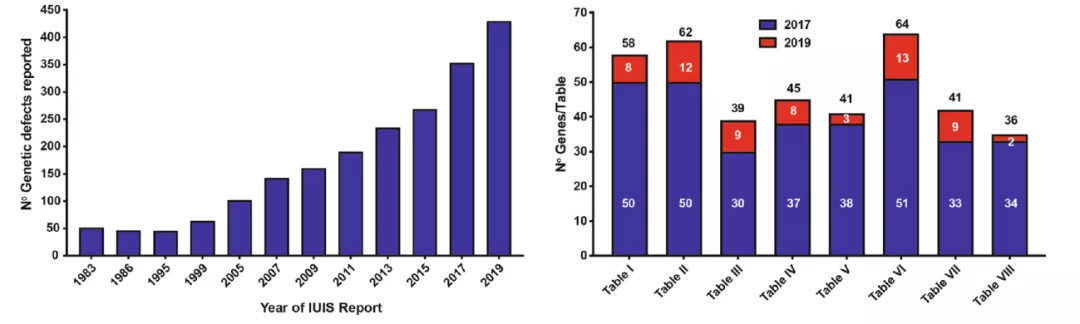
图1 IUIS/WHO委员会在指定年份报告的单基因先天免疫缺陷数量(左)与IUIS委员会在每个表格中列出的致病基因变异数量,每一列中的数字对应于2017年IUIS更新中报告的基因数量(蓝色条)和2019报告中包含的每个表格的新基因数量(红色条,右)。
2017年始,国际免疫学会联合会 (International Union of Immunology Societies,IUIS)首次提出将Primary Immunodeficiency Disease(PID,原发免疫缺陷 ) 更名为 Inborn Errors of Immunity(IEI,出生免疫异常/ 免疫出生错误 ),以避免局限地理解此类疾病只是免疫功能低下或缺失而以易感染为主的疾病,还应该包括诸多免疫功能亢进或失调,临床表现为自身免疫、过度炎症、过敏的孟德尔遗传病。
因此,PID也进行了更新分类(如下):
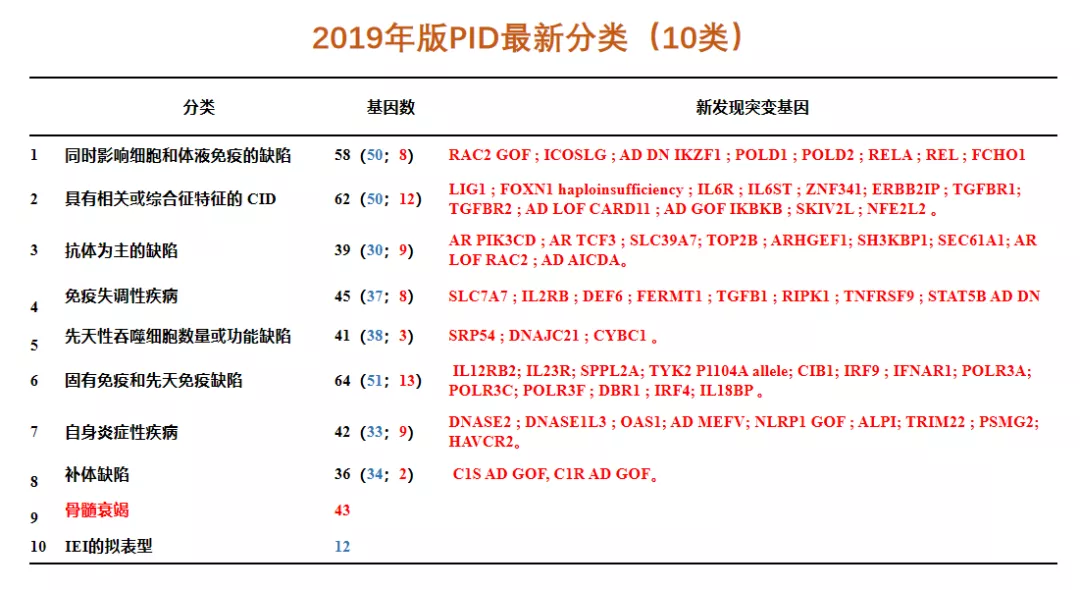
图2 PID分类(2019)
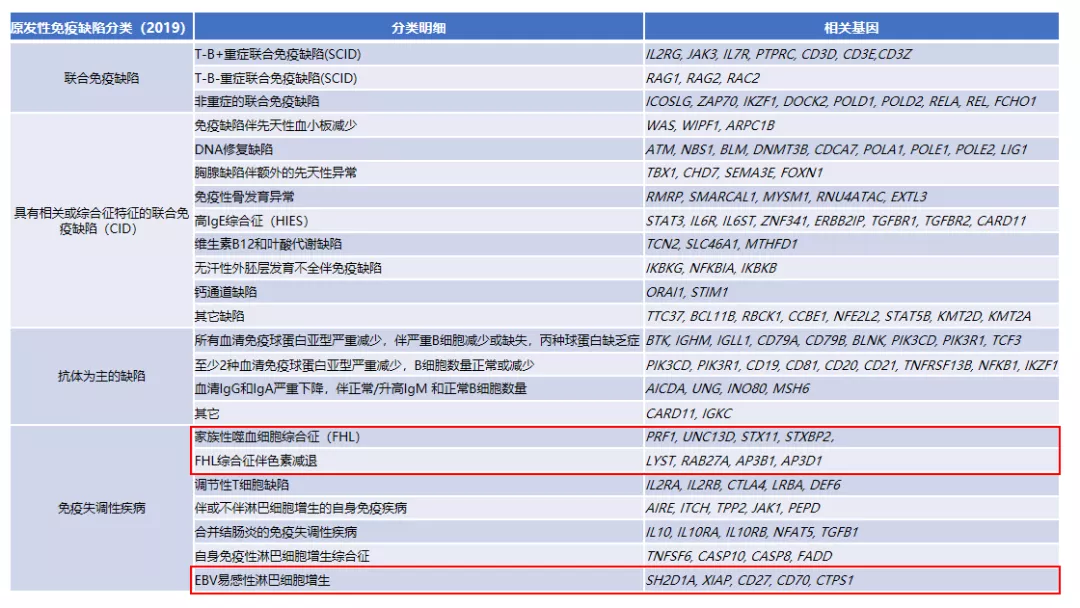
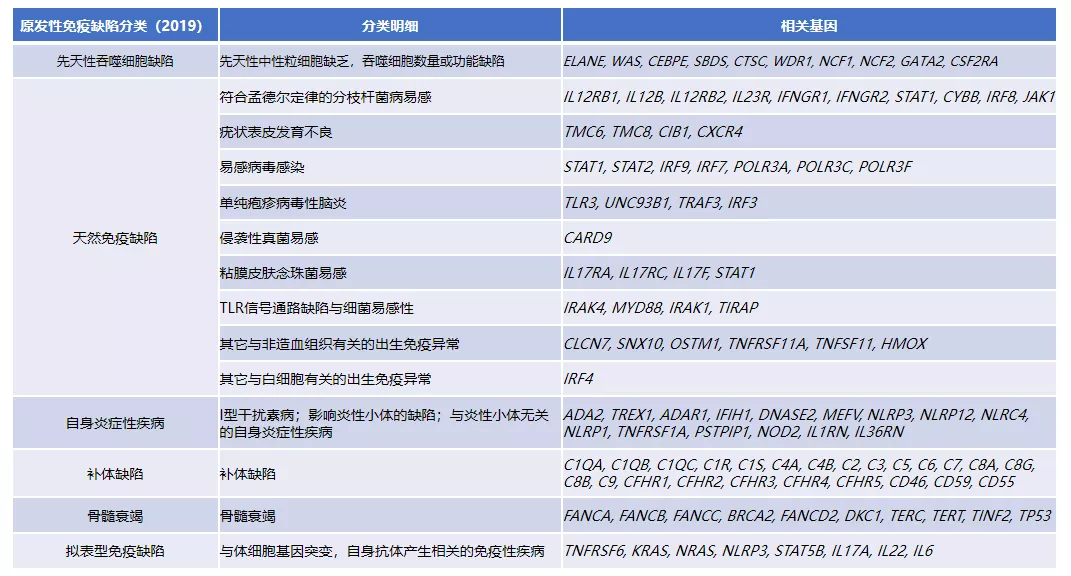
图3 PID分类明细以及相关基因
IEI可能会造成感染、自身免疫、过敏、炎症、癌症、淋巴瘤、骨髓衰竭等疾病。HLH作为一种病理性免疫激活综合征,通常与淋巴细胞毒性的遗传缺陷有关。HLH通常是由CD8 + T细胞过度活化引起的或由感染引发,缺乏正常的细胞杀伤毒性功能,导致T细胞过度活化。虽然巨噬细胞明显参与疾病发展,但T细胞(尤其是CD8 + T细胞)是HLH疾病的关键上游驱动因子。在多种遗传模型中,γ干扰素(IFN-γ)是疾病发展的关键介质,是活化T细胞和巨噬细胞活化之间的主要接头。
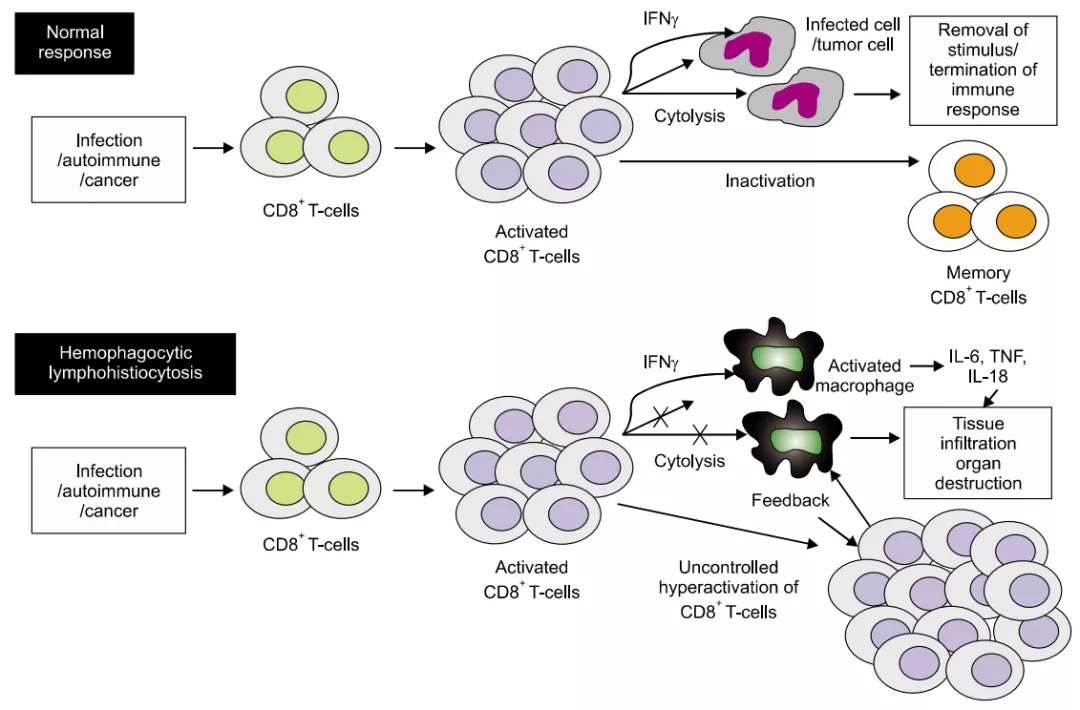
图4 HLH病理示意图
分类而治,分子检测阐明HLH分类
根据缺陷基因的特点将HLH分为家族性HLH(FHL)、与恶性肿瘤相关的HLH、与风湿病相关的HLH(也称为MAS)、免疫激活治疗后观察到的HLH(医源性HLH,也称为细胞因子释放综合征)、免疫缺陷综合征相关HLH、与其他特定条件无关的HLH。
家族性HLH(FHL)共有5个亚型,分别是FHL1、FHL2、FHL3、FHL4、FHL5。目前认为,FHL由遗传性基因变异引起。其中,FHL1相关的基因异常定位于9q21.3-22,但是其编码的蛋白及功能尚不清楚。最早被证实参与HLH发病的基因是与FHL2相关的PRF1,PRF1基因发生突变时,穿孔蛋白异常,不能形成诱导靶细胞凋亡的小孔,减弱了NK细胞或T细胞对靶细胞的杀伤作用。持续的抗原刺激组织细胞或T细胞,进而产生大量的细胞炎症因子和趋化因子,导致HLH发生。
第二个被证实的基因是UNC13D基因,与FHL3发病有关,该基因编码Munc13-4蛋白。STXII是近年来发现的FHL4相关基因,定位于6q24。2009年发现了FHL5相关的STXBP2,该基因编码Munc18-2蛋白。
恶性肿瘤相关HLH:恶性肿瘤患者容易罹患HLH,主要是血液系统肿瘤,可见于淋巴瘤、急性白血病、多发性骨髓瘤、骨髓增生异常综合征等。其中淋巴瘤相关HLH最为常见,尤以T细胞和自然杀伤NK细胞淋巴瘤多见。
与风湿病相关的HLH(也称为MAS): 是HLH的另一种表现形式,目前认为超过30种系统性或器官特异性自身免疫性疾病与HLH相关。其中,全身性青少年特发性关节炎(sJIA)是MAS最多见的病因。系统性红斑狼疮和成人斯蒂尔病也是常见病因。
免疫激活治疗后观察到的HLH(医源性HLH,也称为细胞因子释放综合征)
免疫缺陷综合征相关HLH主要包括Griscelli综合征2(GS-2)、Chediak-Higashi综合征1(CHS-1)和Hermansky-Pudlak综合征Ⅱ(HPS-Ⅱ),缺陷的基因分别为RAB27A、CHS1/LYST和AP3β1。
与其他特定条件无关的HLH: 妊娠、药物、器官和造血干细胞移植也可诱发HLH。
环环相扣,快速、准确诊断HLH
目前公认的HLH诊断标准由国际组织细胞协会于2004年修订,符合以下两条标准中任何一条时可以诊断HLH:
分子诊断符合HLH:在目前已知的HLH相关致病基因,如PRF1、UNC13D、STX11、STXBP2、RAB27A、LYST、SH2D1A、BIRC4、ITK、AP3β1、MAGT1、CD27等发现致病性变异。
符合以下8条指标中的5条:
发热:体温>38.5℃,持续>7天;
脾大;
血细胞减少(累及外周血两系或三系):血红蛋白<90g/L,血小板<100×109/L,中性粒细胞<1.0×109/L且非骨髓造血功能减低所致;
高三酰甘油症和或低纤维蛋白原血症:三酰甘油>3 mmol/L或高于同年龄的3个标准差,纤维蛋白原<1.5g/L或低于同年龄的3个标准差;
在骨髓、脾脏、肝脏或淋巴结里找到噬血细胞;
血清铁蛋白升高:铁蛋白≥500μg/L;
NK细胞活性降低或缺如;
sCD25(可溶性白细胞介素-2受体)升高。
除了上述的8项表现外,以下的临床表现和检查结果也可作为诊断HLH的依据:脑膜刺激症、淋巴结肿大、黄疸、皮疹、水肿、转氨酶升高、低蛋白血症、低钠血症、血脂代谢异常、脑脊液淋巴细胞增多、蛋白含量升高、肝脏组织活检呈慢性持续性肝炎表现。很多HLH患者早期骨髓检查不能发现噬血的典型表现,此时不能以此排除HLH的诊断。
图5 HLH诊断流程示意图
落地实践,遗传/先天易感基因检测如何应用?
目前北京博仁医院对血液淋巴组织肿瘤和免疫系统缺陷相关遗传易感基因检测包括:血液和免疫系统疾病相关遗传易感基因(700+)检测:范可尼贫血(FA)、先天角化不良(DKC)、HLH等;先天免疫缺陷相关基因检测,如免疫失调、联合免疫缺陷等;贫血相关遗传基因检测;遗传性出凝血、血栓性疾病相关基因检测。郑勤龙主任分享的多个病例均显示——遗传易感基因检测能够指导治疗路线的选择。
并且还发现:在携带噬血相关基因变异的患者中,UNC13D突变发生率最高,为43%。观察到UNC13D与LYST、STXBP2、PRF1和ITK存在显著共互斥;LYST与STXBP2和PRF1存在显著共互斥。儿童淋巴瘤合并噬血与UNC13D-mut显著相关。
最后,郑勤龙主任总结道:
免疫缺陷可大致分为原发性或继发性(由HIV感染引起的获得性)
IEI可影响体液免疫或细胞介导的固有免疫防御系统的组分
免疫缺陷可在所有年龄中确诊
IEI可导致感染、炎症、自身免疫、器官功能障碍和淋巴瘤风险增加;
基因检测的使用提供了明确诊断的能力,定义和评估基因型-表型相关性对预后的影响,确定IEI患者的特定治疗。
